Федеральный научно-исследовательский социологический центр Российской академии наук Социологического института РАН (ассоциированный научный сотрудник)
Петровская академия наук и искусств (действительный член)
Россия
Загрязнение всех природных источников питьевой воды хозяйственной деятельностью человека стало предметом крайней озабоченности всех, понимающих эту проблему, как угрозу цивилизации. К числу особо опасных загрязнителей в последнее тридцатилетие отнесли диоксины и диоксиноподобные вещества. В статье авторы приводят обобщённые сведения об опасности загрязнения окружающей среды диоксинами и диоксиноподобными токсикантами. Высказывается предположение о тотальном ослаблении иммунитета населения планеты из-за наличия в окружающей среде диоксинов, являющихся гормоноподобными суперэкотоксикантами. Не исключается фактор массовой подверженности населения короновирусному инфицированию (COVID 19), как следствие воздействия на иммунную систему людей диоксинов и диоксиноподобных веществ. Наиболее перспективным методом очистки питьевой воды авторы считают метод фотокатализа, реализуемый непосредственно в локальном источнике (бытовое потребление, производство бутилированной воды). Рассматривается физико-химический процесс фотокаталитичекой очистки воды с применением в качестве катализатора TiO2, активируемого искусственным ультрафиолетовым излучением. Сообщается о работах, направленных на практическую реализацию мероприятий по очистке питьевой воды.
диоксины, хлорорганика, экология, токсиканты, очистка, питьевая вода, фотокатализ, диоксид титана, ультрафиолет
Загрязнение всех природных источников питьевой воды хозяйственной деятельностью человека стало предметом крайней озабоченности всех, понимающих эту проблему как угрозу цивилизации. К числу особо опасных загрязнителей в последнее тридцатилетие отнесли диоксины и диоксиноподобные вещества.
Эти экотоксиканты, получившие название ксенобиотики, то есть чужеродные живым организмам, являются сильнейшими ядами, превосходящими по токсичности цианистый калий, зарин и многие боевые отравляющие вещества. Они значительно превосходят по токсичности соединения тяжёлых металлов, пестициды, бензапирены.
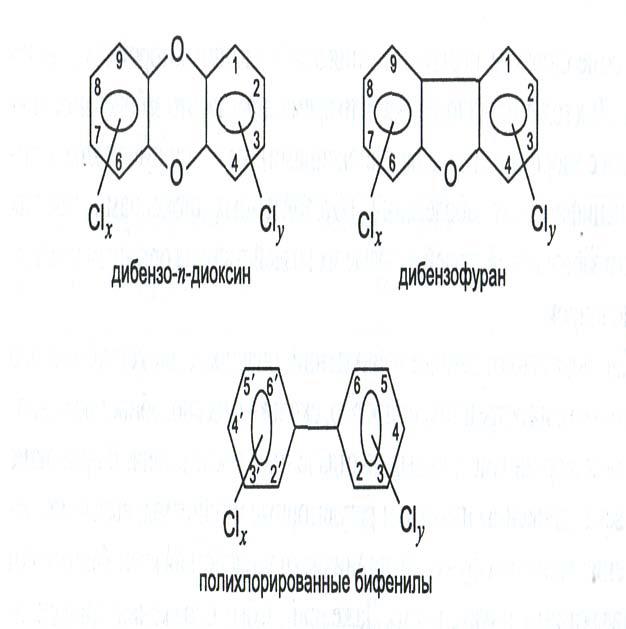
Рисунок 1 – Структурные формулы хлорсодержащих диоксинов, фуранов и бифенилов
Диоксинами именуют большую группу дибензо-n-диоксинов (ПХДД), дибензофуранов (ПХДД) и бифенилов (ПХБФ). Вся группа этих соединений берёт своё начало от 2,3,7,8 –тетрахлордибензо-n-диоксин, который является самым токсичным [1]. Минимальная доза диоксинов, способная убить человека, весящего 70кг, составляет 0,000000000007 г (10-11 г/кг). Нормативами разных стран предельно допустимая концентрация диоксинов в воде составляет (пг/л-пикограмм на литр, т. е. 10-12г/л): в России 20; в США 0,013; в Германии 0,01; в Италии 0,05. Диоксины крайне медленно выводятся из организма и, поступая даже в очень малых дозах, накапливаются до критических для организма значений. Воздействие диоксинов на здоровье человека, на наш взгляд, недостаточно исследовано. Известно, что диоксины ответственны за прогрессирующий иммунодефицит, но нет указаний связи накопленных количеств диоксинов с «пандемией» аллергий. 2018 год ВОЗ назвала годом пандемии аллергии. Широкая распространенность (от 30-60% в популяции) аллергических заболеваний (каждый третий житель планеты страдает аллергическим ринитом и каждый десятый бронхиальной астмой) превратила аллергию в глобальную медико-социальную проблему. Нет сведений об исследовании корреляции вспышки COVID 19 с тем же накоплением диоксинов, хотя заметна выраженная активность вируса COVID19 на территориях с повышенным загрязнением диоксинами: 10 июля 1976 г. в Итальянском г. Севезо (Ломбардия) из труб химического комбината «ICMESA», производящего различные химические вещества (в основном ароматические соединения), при взрыве рабочего котла произошёл выброс ядовитого облака, в котором было около двух килограммов диоксина, вследствие чего произошло тотальное загрязнение 1500 га густо населенной местности, которое впоследствии назвали «итальянским Чернобылем»; в Англии, к северу от Бирмингема, работал сжигатель опасных отходов (фирма Coalite Chemical). В 1991 г. в молоке коров на трех фермах были обнаружены опасные количества диоксинов, поэтому продажа молока с этих ферм была запрещена. Обследование данного района показало, что диоксины накопились не только в почве вокруг сжигателя, но и по фарватеру реки Doe Lea. Даже на расстоянии 1,5 км от места сброса сточных вод были найдены высокие концентрации диоксинов [2]. Именно в указанных нами районах отмечена высокая смертность заразившихся коронавирусом.
Контроль содержания диоксинов в воде крайне труден, проведение анализа одной пробы питьевой воды современными методами будет стоить примерно 1000$ [3, 4].
Вода как продукт, который особенно широко используется людьми для самых различных целей, также может быть подвержена загрязнению диоксинами. Сложность вопроса состоит, однако, в многообразии источников подобных загрязнений. Они могут быть как естественными, так и техногенными, однако чаще всего комбинированными. Это серьезно затрудняет борьбу с диоксиновыми загрязнениями вод. Если обратиться к практике советского и постсоветского периодов, то следует подчеркнуть, что существует немало городов, где диоксины сбрасываются в водные источники промышленными предприятиями. (Здесь и далее, курсивом – авторский комментарий А.Р., Т.М.). Однако имеется множество городов, где главный путь появления ПХДФ и ПХДД – это та или иная форма новообразования диоксинов непосредственно в питьевой воде. Еще в 1980 г. указывалось, что серьезным источником новообразования диоксинов в водопроводных коммуникациях может стать процесс обеззараживания питьевой воды путем обработки ее молекулярным хлором. После очистки воды на водозаборе, без применения хлора, вода направляется в городские сети, где повторно загрязняется патогенной средой и другими загрязнителями. Поэтому воду приходится хлорировать (А.Р., Т.М.). Тогда же было показано, как в процессе хлорирования питьевой воды образуются соединения, способные трансформироваться в диоксиновые. Как оказалось, находящиеся в воде гуминовые и фульвокислоты – естественные источники фенольных веществ - в процессе хлорирования преобразуются в 2,4,5-ТХФ, ПХФ и другие хлорфенолы. Эти предшественники диоксинов действительно были найдены техническими средствами в водопроводной воде. Были найдены также хлорированные феноксифенолы (предиоксины) в воде, загрязненной фенолами, после того как она подверглась обработке хлором. Появилось сообщение об обнаружении ПХФ в сточных водах, после того как они были обработаны хлором. Как оказалось, хлорирование воды молекулярным хлором при обычных температурных условиях даже без специального подбора катализаторов, например, железа, приводит к образованию опасно больших количеств ПХДФ и ПХДД. Таким образом, была экспериментально подтверждена возможность конденсации хлорфенолов в диоксины в реальных условиях водопроводных сетей.
Продолжая тему образования диоксинов за счет естественных источников фенола и техногенного хлора, необходимо отметить, что обеззараживание воды вместо молекулярного хлора продуктами электролиза хлористого натрия, которое иногда применяется в России, должно приводить к еще более сильному загрязнению ее диоксинами. Таким образом, молекулярный хлор как первопричина заражения питьевой воды диоксинами ПХДФ и ПХДД – довольно распространенный диффузный источник этих токсикантов.
Там, где обеззараживание питьевой воды молекулярным хлором является одним из ключевых элементов противоэпидемической водоподготовки, возникновение ПХДД и ПХДФ неизбежно.
В основном, как уже говорилось, образование диоксинов может происходить за счет техногенного хлора и естественных источников фенола, т.е. за счет гуминовых и фульвокислот, лигнинов (лигнин возникает в процессе интенсивного нагрева древесины и древесноподобных материалов, например, при лесных пожарах) и других органических веществ природного происхождения, всегда присутствующих в водных источниках. Примером может служить р. Аму-Дарья, которая серьезно загрязнена фенолами в отсутствие очевидного техногенного источника. Среди естественных веществ подобного рода могут быть также и нехлорированные дибензофуран и дибензо-п-диоксин, которые в процессе водоподготовки могут превращаться в ПХДД и ПХДФ. В принципе, нельзя исключить ситуации, когда не только фенолы, но и молекулярный хлор появляется не из техногенной сферы, а естественным, как и природные органические вещества, образом. Почти все природные воды содержат хлор. В породах земли почти повсеместно встречается NaCl – поваренная соль.
В условиях планетарного дефицита питьевой воды большие надежды связываются с подземными источниками. Существует опасное заблуждение по поводу безупречного качества воды из подземных источников. Подземной гидросфере, как и наземной не удалось уберечься от загрязнений, производимых человеческой хозяйственной деятельностью.
Исходя из характера пустот водовмещающих пород, подземные воды в обломочных породах (например, песок), называют поровые; в растворимых породах (гипс, доломит, известняк) - карстовые или трещинно-карстовые; и в скальных породах (гранит) - трещинные или жильные.
По условиям залегания подземные воды делят на: межпластовые, почвенные, грунтовые и верховодку [5].
Основными источниками загрязнения подземных вод принято считать: ненадлежащим образом устроенные свалки; хранилища ядовитых веществ; протекающие резервуары автозаправочных станций; пестициды; удобрения. Наконец, аварийные утечки особенно опасных веществ химических и нефтехимических предприятий. Источниками загрязнения подземных вод могут быть разливы и утечки нефти на нефтебуровых участках, присутствие нефти в стволах скважин, где имеется выход в водный горизонт. Проникающие различными путями в водные горизонты загрязнители переносятся течениями на большие расстояния. В подземных условиях эти вещества долго сохраняются и очистка от них крайне затруднительна, а во многих случаях невозможна и, конечно, требует больших затрат. Интенсивная миграционная способность диоксинов объясняет их присутствие вдали от мест, где они образовались [6–8]. С 2012 года в России разрешено обрабатывать скважины хлорорганическими соединениями.
Загрязнение диоксинами водных источников Ленинградской области
Ленинградская область богата водными ресурсами, в ряду которых особое место занимает Ладожское озеро. Об уникальности этого объекта, его значении для человеческой популяции много сказано, и ещё многое предстоит открыть. О неблагоприятной экологической обстановке, сложившейся в водной среде Ладожской гидросистемы экологи, уже не первый год, бьют тревогу, озабочены этой проблемой как центральные, так и региональные власти [9]. Потенциальными источниками диоксинов в Ленинградской области являются: АО «Сясьский целлюлозно-бумажный комбинат»; Целлюлозный завод «Питкяранта»; Светогорский целлюлозно-бумажный комбинат; Киришский НПЗ «Сургутнефтегаз»; иловые площадки на территории Ленинградской области; металлообрабатывающие предприятия в Санкт-Петербурге и Ленинградской области; Бокситогорский завод «Полимер»; Завод «Полимерстройматериалы»; НПО «Пигмент»; Охтинское НПО «Пластополимер»; водоснабжающие предприятия, хлорирующие воду; лесные пожары.
Серьезную проблему представляют медицинские отходы. Их уничтожение должно проводиться на специальных установках (инсинераторах). Как показывает мировая практика, содержание ПХДД/Ф в выбросах предприятий по переработке медицинских отходов приближается к выбросу установок для уничтожения промышленных отходов. Мероприятия по улучшению качества утилизации медицинских отходов в России пока не осуществляются. По-видимому, перечень источников диоксинового загрязнения не полон, но и перечисленного достаточно для понимания того, сколь важен контроль поступления ксенобиотиков в окружающую, в том числе водную, среду.
Контроль наличия диоксинов в воде
В настоящее время лишь ограниченное число аналитических лабораторий развитых стран способны проводить анализы на диоксины рядов ПХДД и ПХДФ любой степени сложности, в частности, осуществлять их количественное определение в образцах различных типов. Имеются в виду лаборатории Швеции, Швейцарии, США, Канады, Италии, Германии, Японии, Нидерландов, Франции и Норвегии. В России также есть лаборатории, способные провести анализ наличия диоксинов на самом высоком уровне [10]. Однако, о ведении систематического повсеместного мониторинга загрязнения среды диоксинами в России и на всём постсоветском пространстве нам не известно. Для качественного анализа наличия диоксинов с раздельным определением групп необходимы хроматографы и масс-спектрометры с высоким разрешением. Стоимость анализа одной пробы довольно высокая и требует значительных затрат времени, что естественно сужает фронт мониторинга.
Очистка воды от диоксинов
Из нетермических методов очистки воды от диоксинов назовём:
– химическое дехлорирование;
– химическое разрушение с помощью RuO4, пероксида водорода, озона и других мощных окислителей;
– химическое разрушение с помощью хлориодидов;
– фотодеструкция;
– гамма-радиолиз;
– комбинированные методы с использованием фотодеструкции (термическая десорбция, УФ-фотолиз и т.д.);
– биологическое разрушение;
– методы извлечения (сорбция, экстракция и т.д.);
Не все из перечисленных технологий способны удовлетворить стандарту, принятому в цивилизованных странах. В частности, в США стандарт 40 CFR 264.343, установленный ЕРА, должен обеспечивать уничтожение и удаление 99,99% всех основных опасных компонентов, а для наиболее опасных органических компонентов токсических отходов, таких, как ПХДД, ПХДФ и ПХБ – разрушение и уничтожение на 99,9999%.
Технологии разработаны, вот только для очистки питьевой воды от диоксинов и диоксиноподобных веществ ни одну из этих технологий практически приспособить не удалось. Теоретические разработки, указывающие путь перспективных инженерно-технических решений очистки воды от диоксинов, можно признать достаточно завершёнными. Однако, эффективных установок, приемлемых по цене, надёжности, относительно простых и удобных в эксплуатации, не создано. Техническому решению должно предшествовать организационное.
Очистка воды на водозаборах предприятий «Водоканала» особого смысла не имеет по той причине, что, во-первых, вода в сетях вновь окажется заражённой, во-вторых, цена воды заметно возрастёт при том, что в большинстве случаев она используется не только в качестве питьевой, но и в качестве технической. Выход из этого тупика возможен либо на пути создания системы обеспечения населения бутилированной качественной питьевой водой, что уже довольно распространено, либо на пути создания бытовых приборов приготовления качественной питьевой воды из воды водопроводной, скважинной, колодезной и др. Возможно сочетание этих путей. Социальный заказ на такую продукцию есть и будет нарастать, что должно стимулировать соответствующие инженерные разработки. Просвещение населения, добросовестное поведение на рынке качественной воды создадут благоприятные условия как для бизнеса в этом сегменте, так и для развития технологии очистки воды от «жестоких» загрязнителей.
К настоящему времени наиболее перспективным признан фотокаталитический метод очистки воды. Основные недостатки этого метода заключаются в относительно сложном оборудовании, тонкой его настройке и небольшой скорости очистки. Развитие и совершенствование технологии приведёт к упрощению и унификации оборудования, как это обычно и происходит. Но, это дело будущего.
Разработанные методы фотокаталитической очистки сегодняшнего дня направлены на очистку воды на пути её движения к питьевым водоёмам. Чаще всего рассматривают проекты фотокаталитической очистки всевозможных стоков, с использованием солнца в качестве источника ультрафиолета с целью экономии энергозатрат. Такие проекты могут предусматривать очистку больших объёмов стоков. Периодическое отсутствие солнечного света, малая доля необходимой спектральной составляющей в солнечном спектре, низкая скорость очистки не являются препятствием для их реализации. Иначе обстоит дело с очисткой воды на пути к её непосредственному употреблению в качестве питья или приготовления пищи и пищевых продуктов. (Мы не затрагиваем проблему использования воды в животноводстве, рыбоводстве и растениеводстве — это тема отдельного разговора). При использовании фотокаталитической очистки малых объёмов воды требуется искусственный ультрафиолет, определённая – как правило повышенная – скорость очистки, требуется комплексная очистка. Учитывая сравнительно небольшие потребности в питьевой воде и микроскопические количества диоксинов в ней, расчётное значение скорости очистки можно признать приемлемым. Высказываемые иногда опасения по поводу возможности появления побочных вредных соединений, не обоснованы, поскольку неблагоприятные итоги фотокатализации связаны не с самим методом, а с ошибками организации и проведения процесса очистки.
Фотокатализ
Эффект фотокатализа заключается в минерализации хлорорганических загрязнений на поверхности катализатора под действием ультрафиолетового излучения. Эффект открыт ещё в начале прошлого века. Однако научный и практический интерес к фотокатализу возник только в 1970 году и связан с работами А. Фуджишима, которые открыли путь для широкого применения диоксида титана при конверсии солнечной энергии [11].
Фотокаталитическим свойствам диоксида титана посвящено огромное количество работ [12–15], и много других, среди которых отметим достаточно обстоятельную работу [16].
Фотокаталитическую очистку воды мы рассматриваем в связи с применением катализатора на основе наноразмерных частиц диоксида титана TiO2, облучаемых искусственно созданным ультрафиолетом, с длиной волны порядка 275 нм. Особенность диоксида титана заключается в том, что один из его электронов под воздействием ультрафиолетового облучения переходит из связанного состояния в свободное – из валентной зоны в зону проводимости. В свободном состоянии электроны движутся по кристаллической решетке, в связанном состоянии (основном), электроны притянуты к какому-либо иону кристаллической решетки и участвуют в образовании химической связи.
В результате поглощения молекулой диоксида титана кванта света образуется пара частиц, несущих заряд – отрицательно заряженный свободный электрон и положительно заряженный ион TiO2+ - электронная вакансия, так называемая дырка. Молекула TiO2 становится полупроводником с дырочной проводимостью. Потенциал ионизации дырки составляет не менее 3,2 эВ. Часть из этих пар вновь объединяется - рекомбинирует, часть мигрирует в полупроводнике, частично локализуясь на структурных дефектах его кристаллической решетки. Процесс фотоактивации диоксида титана можно представить формулой (1).
По-видимому, и электроны и дырки вполне конкретные частицы: дырки – это электронные вакансии, которые локализуются на поверхностном решетчатом кислороде, образуя О-, а электроны – Ti 3+. Потенциал дырки ~ 3 эВ, потенциал электрона ~0,1эВ. относительно нормального водородного электрода.
Электроны и дырки являются сильными окислителями и восстановителями. Вакансия (дырка) способна окислить, то есть, оторвать электрон у тех органических соединений, с которыми она соприкасается, в том числе у диоксинов.
Схематически процессы, происходящие на поверхности диоксида титана, показаны на рисунке (этот рисунок, так же как рисунок 3, представлен почти во всех статьях, посвящённых фотокатализу).

Рисунок 2 – Схема фотогенерирования окислительных агентов на поверхности TiO2. В присутствии электронакцепторных А и электрондонорных соединений D
Окислительно-восстановительные процессы выглядят следующим образом:
е- + Н2О → НО• + Н• (2)
р+ + Сх Ну Оz → Сх Ну-1 Оz + Н+ (3)
р+ + Н2О → НО• +Н+ (4)
р+ + ОН- → НО• (5)
В воде имеется растворённый кислород. В результате восстановления кислорода электронами возникают супероксидный, гидропероксидный радикалы и пероксид водорода.
е- + О2 → О2• (6)
О2• - + Н+ → НО2• (7)
О2• - + е- + 2Н+ → Н2О2 (8)
Пероксид водорода также образуется при взаимодействии гидропероксидных радикалов и рекомбинации радикалов гидроксильных.
2НО2• → Н2О2 + О2 (9)
2НО• (НО•) → Н2О2 (10)
Под воздействием ультрафиолета с длиной волны менее 300 нм пероксид водорода диссоциирует с образованием гидроксильных радикалов
Н2О2 + hν → 2НО• (НО•) (11)
Гидроксильный радикал, атомарный кислород, пероксид водорода, а также возникающий под воздействием электрического разряда (об этом будет сказано ниже) озон О3, являются сильнейшими скейвинджерами (поглотителями) электронов, то есть окислителями.
Поскольку в процессах возникает Н• (формула 2), укажем ещё на одну возможную реакцию
Н• + Н• → Н2 (12)
Формула (3) иллюстрирует процесс фотокаталитической деструкции органического соединения.
Ультрафиолетовое излучение средней жёсткости, используемое для фотоактивации диоксида титана, генерирует озон О3. Озон быстро распадается на молекулярный и атомарный кислород. В целом, как мы видели, происходит цепь окислительно-восстановительных реакций, в результате которых образуются чрезвычайно эффективные окислители, которые разрывают связь хлора с органикой и, затем, окисляют органику до СО2 и Н2О, что исключает повторную возможность образования полихлорированных циклических углеводородов – диоксинов. Схематически процесс фотоокисления показан на рисунке 2.
Запрещённая зона у TiO2 довольно широкая 2,9 – 3,2 эВ, что определило его высокие фотокалитические свойства: чем шире полоса, тем менее вероятна электрон-дырочная рекомбинация. Этой полосе соответствует диапазон длин волн инициирующего ультрафиолета в пределах 250 – 400 нм. Выбирая из этого диапазона рабочую длину волны, следует учесть, что слишком жёсткий ультрафиолет ограничивает возникновение озона х15ъ [17], слишком мягкий ограничивает выход электон-дырочных пар. Решение этого противоречия возможно осуществить применением специальных технических решений, на основе импульсного возбуждения ультрафиолета непосредственно в воде.
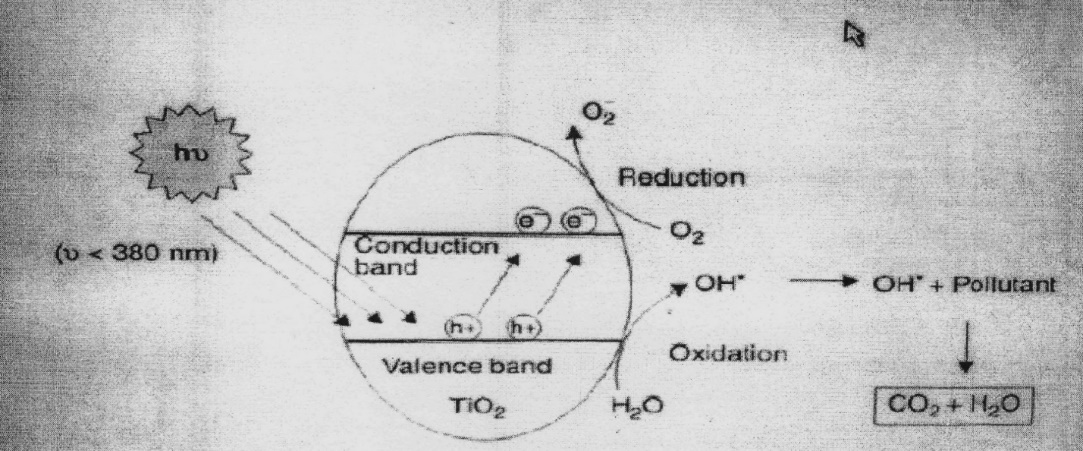
Рисунок 3 – Механизм фотокаталитического окисления.
Наноструктурированные титановые покрытия
Достаточно полное изложение физико-химических свойств диоксида титана и технологии изготовления фотокаталитических покрытий из него приведено в диссертации А.Н. Морозова «Синтез и каталитические свойства наноструктурированных покрытий диоксида титана» [18].
Оптические, абсорбционные, сенсорные и другие свойства диоксида титана известны давно. Диоксид титана является основным, и даже, вероятно, единственным пигментом белого цвета, применяемым в лакокрасочной промышленности. В последние годы особое внимание уделяется фотокаталитическим свойствам диоксида титана. Разработчики фотокатализаторов сетуют на довольно низкую квантовую активность диоксида титана, связанную со слабым разделением пары электрон – дырка. Заметим, что низкая эффективность, определяемая ограниченностью спектра поглощения ультрафиолетового излучения, имеет место, когда речь идёт о солнечном ультрафиолете, поскольку в спектре солнечного света ультрафиолет с длиной волны, способной обеспечить переход электрона из валентной зоны в зону проводимости, находится на краю спектра. При этом жесткость его весьма невелика: длина волны ~ 400 нм., а доля его в солнечном спектре ~ 5%.
Решением проблемы применения диоксида титана в качестве фотокатализатора, активируемого солнечным ультрафиолетом, занимаются учёные всего мира. Диоксид титана привлекателен, поскольку он нетоксичен, химически инертен, недорог.
Увеличения эффективности выхода электрон-дырочных пар можно добиться за счёт применения искусственного, более жёсткого, ультрафиолета и наноразмерных частиц (<50 нм) TiO2. Создание поверхностей, надёжно удерживающих наночастицы TiO2, непростая инженерно-технологическая задача.
Диоксид титана существует в трёх фазовых состояниях: анатаз; рутил и брукит. В состоянии анатаза диоксид титана в наибольшей степени проявляет свои фотокаталитические свойства [19,20,21]. Из известных коммерческих фотокатализаторов назовём Hombikat UV 100 («Sachtlebem», Германия), который состоит только из анатаза и имеет высокую активность.
Использование наноразмерных частиц TiO2 способствует значительному увеличению поверхности фотокатализатора, увеличению вероятности выхода электрон-дырочных пар на его поверхность, поскольку глубина проникновения инициирующего излучения может достигать 100 нм, следовательно, путь движения зарядов к поверхности увеличивается и в процессе участвует только тонкий поверхностный слой. Детально процесс рассмотрен в обзоре полупроводниковых катализаторов в статье Милса и Ханта [22]. Это обстоятельство иллюстрируется на рисунке 4.
Микрочастица Наночастица
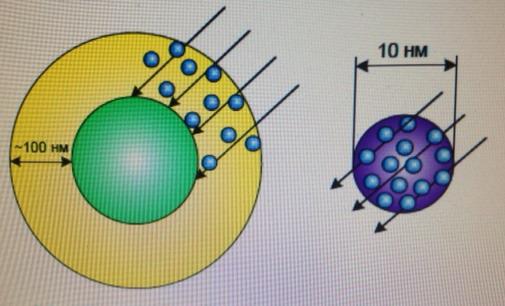
Рисунок 4 – Поглощение ультрафиолета в микрочастице и наночастице
Приведённые теоретические доводы, позволяют наметить пути решения проблемы фотокаталитической очистки питьевой воды от хлорорганических загрязнителей в практическую плоскость. Наиболее привлекательным и реалистичным представляется создание бытового прибора, доступного широким слоям потребителей.
Разработкой опытного образца прибора в настоящее время занимается предприятие ООО «АРЭФ».
Комплексность очистки
Разрабатываемая технология очистки воды от диоксинов содержит процесс электрических разрядов в воде. Возникающие при электрическом разряде ультрафиолетовое излучение, пероксид водорода H2O2, озон О3, атомарный кислород О, гидрооксидион ОН, наряду с активацией фотокатализатора, оказывают губительное воздействие на патогенную среду, обеззараживая воду [23–26].
Одними из распространённых загрязнителей питьевой воды, в том числе подземной, являются марганец и железо [27]. Чаще железо встречается в соединении Fe(HCO3)2 - это двухвалентное железо в форме растворённого карбоната. Очистить воду от двухвалентного железа довольно трудно. Вначале двухвалентное железо преобразуют в трехвалентное, которое имеет свойство коагулироваться, а затем хлопья трехвалентного железа можно либо осадить, либо отфильтровать пост-фильтром (размер ячеи ~ 1мкм).
О способах очистки питьевой воды от железа имеется достаточно обширная информация [28, 29]. Довольно часто применяется способ окисления двухвалентного железа, при котором оно переходит в трехвалентное [30].
Рассмотренный нами фотокаталитический способ очистки воды от диоксинов, как мы выяснили, производит целый комплекс окислителей, способных окислить двухвалентное железо. Например, взаимодействие пероксида водорода с двухвалентным железом переводит его в трёхвалентное [31]:
H2O2 + Fe2+ → Fe3+ + OH• + OH –
Окисление озоном рассмотрено в работе В.Л. Драгинский, Л.П. Алексеева, В.Г. Самойлович «Озонирование в процессах очистки воды» [32].
Специалистами предприятия ООО «Ассоциация радио-электрофизиков», г. Саратов разработаны методики создания фотокаталитических фильтров, необходимых для производства бытовых приборов очистки воды.
1. Клюев Н.А., Шелепчиков А.А. Проблема загрязнения окружающей среды полихлорированными дибензо- n-диоксинами и диоксиноподобными веществами // Диоксины суперэкотоксиканты XXI века инф. вып. / под ред. Ю.М. Арского. - M.: ВИНИТИ. 2000. - Вып. 6. - С. 5-43.
2. Загрязнение воды [Электронный ресурс]. - Режим доступа: http://www.ecololocate.ru/locats-77-1.html/ (дата обращения: 11.08.2020).
3. Диоксины и их воздействие на здоровье людей [Электронный ресурс]. - Режим доступа: https://www.who.int/ru/news-room/fact-sheets/detail/dioxins-and-their-effects-on-human-health (дата обращения: 10.09.2020).
4. Бабенко О.В. Диоксины - проблема XXI века // Медицинская помощь. - 2000. - № 5. - С. 32-35.
5. Кирюхин В.А., Коротков А.И., Пылов А.Н. Общая гидрогеология. - Л.: Недра. 1988.
6. Scholz B., Engler M. // Chemosphere. - 1987. - Vol.16. - N 8/9. - P.1829-134.
7. Pereira W.E., Rostad C.E., Sisak M.E. // Environ. Toxicol. Chem. -1986. - Vol.4. - N 5. - P.629-639.
8. Puri R.K., Kapila S., Lo Y.-H. et al. // Chemosphere. - 1990. - Vol.20. - N 10/12. - P.1589-1596.
9. Доклад об экологической ситуации в Санкт-Петербурге в 2018 году / Под редакцией И.А. Серебрицкого. - СПб: ООО «Сезам-принт», 2019.
10. Другов, Ю. С. Экологические анализы при разливах нефти и нефтепродуктов: Практическое руководство / Другов Ю.С., Родин А.А., -2-е изд., перераб. и доп. - Москва: БИНОМ. ЛЗ, 2017. - 270 с.
11. Fujishima A.,Honda K. Electrochemical Photolysis of Water at a Semiconductor Electrode // Nature 238, 37-38; doihttps://doi.org/10.1038/238037a0
12. Пармон В.Н. Фотокатализ: Вопросы терминологии // Фотокаталитическое преобразование солнечной энергии / Ред. К.И. Замараев, В.Н. Пармон. - Новосибирск: Наука, 1991. - С. 7-17.
13. Соболева Н.М., Носонович А.А., Гончарук В.В. Химия и технология воды // Гетерогенный катализ в процессах обработки воды. - 2007. - Т.29. - №2. - С.125-159.
14. Савинов Е.Н. Фотокаталитические методы очистки воды и воздуха // Соровский образовательный журнал. - 2000. - Т.6. - №11. - С. 52-56.
15. Кофман В. Я. Новые окислительные технологии (часть 1) // Водоснабжение и санитарная техника. - 2013. - № 10. - С. 68-78.
16. Миннеханов А.А. Фотоэлектронные процессы в наноструктурированных материалах на основе диоксида титана с парамагнитными центрами [Электронный ресурс]. - Режим доступа: https://istina.msu.ru/dissertations/103265307/ (дата обращения: 8.09.2020).
17. Пискарев И.М., Ушканов В.Д., Селемир В.Д., Малеванная (Пикарь) И.А., Зуймач Е.А. Образование озона и УФ-излучение мощных импульсных разрядов. // Журнал Физической Химии. - 2008. - Т.8. - №9. - С.1-5.
18. Морозов А.Н. Синтез и каталитические свойства наноструктурированных покрытий диоксида титана: дис. на соискание степени к.х.н. - М., 2014.
19. Linsebigler A. L., Lu G., Yates J. T. Photocatalysis on TiO2 Surfaces: Principles, Mechanisms, and Selected Results // Chemical Reviews. - 1995. - V.95. - P. 735-758.
20. Tanaka K., Mario F.V. Capule, Hisanaga T. Effect of crystallinity of TiO2 on its photocatalytic action // Chemical Physics Letters. - 1991. - V.187. -№1. - P. 73-76.
21. Mills A., Hunte S. L. An overview of semiconductor photocatalysis // Journal of Photochemistry and Photobiology A: Chemistry. - 1997. - V.108. - №1. - P. 1-35.
22. Mills A., Hunte S. L. An overview of semiconductor photocatalysis // Journal of Photochemistry and Photobiology A: Chemistry. - 1997. - V.108. - № 1. - P. 1-35.
23. Устройство для обеззараживания и очистки воды: пат. 137284 Рос. Федерация И.Ф. Суворов, С.В. Какауров, Т.В. Рахлецова, Р.Т. Аскаров, А.И. Солдатов, А.С. Юдин. № 2013128091/05. заявл. 19.06.2013, опубл. 10.02.2014. Электро № 4 38, Электро. № 4 32;
24. Какауров С.В., Соловьёва Т.Л., Юдин А.С., Суворов И.Ф. Сидоров А.И. Исследование эффективности установок обеззараживания воды, оснащённых импульсным источником питания с повышенными электробезопасными свойствами // Электробезопасность. - 2014. - № 4. - С. 31-38.
25. Корнев Я.И. Обработка воды импульсными разрядами в водовоздушном потоке: дис. канд. техн. наук. - Томск: Томск. политехн. ун-т, 2005. - 162 с.
26. Томилова О. С. Повышение качества водоподготовки в пассажирских вагонах на основе системы контроля дозы облучения в проектируемых конструкциях ультрафиолетовых стерилизаторов: дис. на соискание ученой степени канд. техн. наук. - Омск, 2015.
27. Мачехина К.И. Железо в подземных водах // Перспективы развития фундаментальных наук: Материалы V Международной конференции студентов и молодых ученых, Томск, 20-23 мая 2008. - Томск: ТПУ, 2008. - С. 169-171.
28. Фрог Б.Н. Водоподготовка. Учебное пособие для вузов / Под редакцией Николадзе Г.И. - М.: Издательство МГУ, 2001.
29. Курбатов А.Ю., Аснис Н. А., Ваграмян Т.А. Способы очистки воды от растворенного железа и марганца // Химическая промышленность сегодня. - 2012. - № 4. - С. 48.
30. Аснис H.A., Баталов P.C., Борткевич C.B., Ваграмян Т.А., Курбатов А.Ю. Очистка воды от железа с использованием волновых гидродинамических устройств // Химическая промышленность сегодня. - 2012. - № 9. - С.36.
31. Соболева Н.М., Носонович А.А., Гончарук В.В. Химия и технология воды // Гетерогенный катализ в процессах обработки воды. -2007. - Т.29. - № 2. - С.125-159.
32. Драгинский В.Л., Алексеева Л.П., Самойлович В.Г. Озонирование в процессах очистки воды / Под общей ред. В.Л.Драгинского. - М.: ДеЛи принт, 2007.









